Un atome de configuration électronique est une représentation numérique de son électron orbitales. Aux orbites électroniques sont de formes différentes régions autour d'un noyau d'atome où les électrons sont mathématiquement susceptibles d'être situé. Un électron de configuration peuvent rapidement et simplement dire à un lecteur de combien d'électrons orbitales d'un atome est ainsi que le nombre d'électrons de remplissage de chacun de ses orbitales. Une fois que vous comprenez les principes de base derrière configuration électronique, vous serez en mesure d'écrire vos propres configurations et de s'attaquer à ceux de la chimie des tests avec confiance.
Mesures
@@_
@@
Méthode 1
Attribution d'Électrons à l'Aide d'un Tableau Périodique

1
@@_
@@Trouver votre atome de numéro atomique. Chaque atome a un nombre précis d'électrons associés. Recherchez votre atome de symbole chimique du tableau périodique. Le numéro atomique est un nombre entier positif à partir de 1 (pour l'hydrogène) et augmente de 1 pour chaque atome. L'atome de numéro atomique est le nombre de protons de l'atome - ainsi, c'est aussi le nombre d'électrons dans un atome avec zéro frais.2
@@_
@@de Déterminer la charge de l'atome. Sans inculpation atomes aura exactement le nombre d'électrons qui est représentée sur le tableau périodique. Cependant, les atomes chargés aura une augmentation ou une diminution du nombre d'électrons en fonction de l'importance de leur charge. Si vous travaillez avec un atome chargé, d'ajouter ou de soustraire des électrons en conséquence: ajouter un électron pour chaque charge négative et soustraire un pour chaque charge positive.
- Par exemple, un atome de sodium avec un 1 charge aurait un électron de s'éloigner de ses base du numéro atomique de 11. Ainsi, l'atome de sodium aurait 10 électrons au total.
3
@@_
@@Mémoriser la liste de base des orbitales. Comme un atome gains électrons, ils remplissent différentes orbitales ensembles selon un ordre spécifique. Chaque ensemble d'orbitales, lorsqu'il est complet, contient un nombre pair d'électrons. Les orbitales ensembles sont:
- La s orbital jeu (n'importe quel nombre dans la configuration électronique suivi d'un 's') contient une seule orbitale, et par le Principe d'Exclusion de Pauli, une seule orbitale peut contenir un maximum de 2 électrons, de sorte que chaque s orbitale peut contenir 2 électrons.
- L'orbitale p set contient 3 orbitales, et donc peut contenir un total de 6 électrons.
- Le d orbital set contient 5 orbitales, de sorte qu'il peut contenir 10 électrons.
- La f orbital set contient 7 orbitales, de sorte qu'il peut contenir 14 électrons.
Rappelez-vous l'ordre des lettres avec ce mnémonique:[1]Sobre, les Physiciens Ne Trouvez pas les Girafes se Cachant Dans les Cuisines.Pour des atomes avec encore plus d'électrons, les orbitales continuer par ordre alphabétique passé K, de sauter des lettres déjà utilisé.
4
@@_
@@Comprendre la configuration électronique de la notation. Electron configurations sont rédigés de manière à afficher clairement le nombre d'électrons dans l'atome ainsi que le nombre d'électrons dans chaque orbitale. Chaque orbitale est écrit dans l'ordre, avec le nombre d'électrons dans chaque orbitale écrit en exposant à droite de l'orbitale nom. La finale de la configuration électronique est une chaîne unique de l'orbite des noms et des exposants.
- Par exemple, voici une simple configuration électronique: 1s2 2s2 2p6. Cette configuration montre qu'il y a deux électrons dans l'orbitale 1s ensemble, deux électrons dans l'orbitale 2s ensemble, et six électrons dans l'orbitale 2p ensemble. 2 2 6 = 10 électrons total. Cette configuration électronique est un non chargé néon atome (néons de numéro atomique est de 10.)
5
@@_
@@Mémoriser l'ordre des orbitales. Notez que les orbitales séries sont numérotées par des électrons shell, mais commandé en termes d'énergie. Par exemple, une fois rempli, un 4s2 est plus faible énergie (ou du moins potentiellement volatils) que partiellement remplis ou rempli 3d10, de sorte que le 4s coque est indiqué en premier. Une fois que vous savez l'ordre du reservoir, il vous suffit de remplir leur fonction du nombre d'électrons dans l'atome. L'ordre de remplissage des orbitales est comme suit: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7p, 5f, 6d, 7p, 8s.
- Une configuration électronique d'un atome à chaque orbitale complètement rempli serait écrit: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d107p6
- Notez que la liste ci-dessus, si toutes les coquilles ont été remplis, ce serait la configuration électronique pour Uuo (Ununoctium), 118, le plus grand numéro de l'atome dans le tableau périodique - donc cette configuration électronique contient tous connus à l'heure actuelle de la couche électronique pour une charge neutre atome.
6
@@_
@@Remplir le reservoir en fonction du nombre d'électrons dans votre atome. Par exemple, si nous voulons écrire un électron de configuration pour un non chargé atome de calcium, nous allons commencer par trouver son numéro atomique sur le tableau périodique. Son numéro atomique est de 20, de sorte que nous allons écrire une configuration pour un atome à 20 électrons selon l'ordre ci-dessus.
- Remplir reservoir selon l'ordre ci-dessus jusqu'à ce que vous atteindre vingt total d'électrons. L'orbitale 1s obtient deux électrons, le 2s obtient deux, la 2p obtient six, le 3s obtient deux, le 3p obtient 6, et le 4s obtient 2 (2 2 6 2 6 2 = 20.) Ainsi, la configuration électronique de calcium est: 1s2 2s2 2p6 3s2 3p6 4s2.
- Note: le niveau d'Énergie des modifications que vous allez vers le haut. Par exemple, lorsque vous êtes sur le point d'aller jusqu'à la 4ème niveau d'énergie, il devient 4s d'abord, puis en 3d. Après le quatrième niveau d'énergie, vous vous déplacez sur le 5e, où il suit l'ordre une fois de plus. Cela se produit uniquement après la 3ème niveau d'énergie.
7
@@_
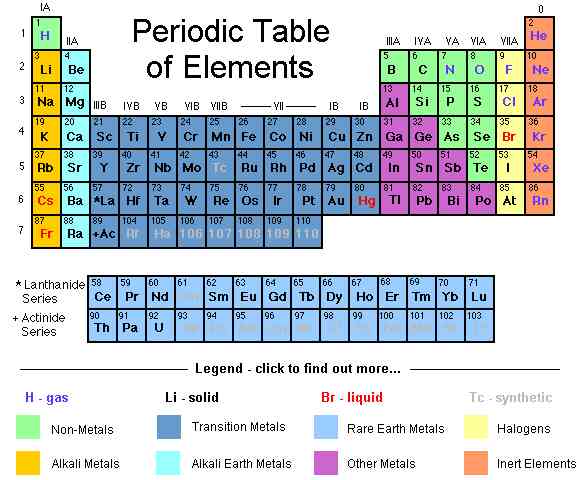
@@Utiliser le tableau périodique comme un raccourci visuel. Vous avez peut-être déjà remarqué que la forme de la table périodique correspond à l'ordre de l'orbite de jeux dans des électrons configurations. Par exemple, les atomes dans la deuxième colonne en partant de la gauche, de toujours se terminer par 's2', des atomes à l'extrême droite de la maigre partie médiane toujours la terminaison 'd10', etc. Utiliser le tableau périodique comme un guide visuel pour écrire des configurations de l'ordre dans lequel vous ajoutez les électrons des orbitales correspond à votre position dans le tableau. Voir ci-dessous:
- plus Précisément, les deux colonnes de gauche représentent des atomes dont les électrons configurations de fin dans les orbitales s, le bloc de droite de la table représente les atomes dont les configurations fin dans les orbitales p, la partie médiane, les atomes de cette fin d orbital, et la partie inférieure, les atomes qui se terminent en f orbitales.
- Par exemple, lors de l'écriture d'une configuration électronique du Chlore, pense que: 'Cet atome est dans la troisième rangée (ou 'période') du tableau périodique. C'est aussi dans la cinquième colonne du tableau périodique de l'orbitale p du bloc. Ainsi, sa configuration électronique ...3p5
- Attention - le d et f orbital régions du tableau correspondent à des niveaux d'énergie qui sont différentes de celles de la période où ils sont situés. Par exemple, la première ligne de la d orbital bloc correspond à la 3d orbital même si c'est en période 4, tandis que la première ligne de la f orbitale correspond à l'orbitale 4f même si c'est en période de 6.
8
@@_
@@Apprendre la sténographie pour la rédaction long de l'électron configurations. Les atomes le long du bord droit du tableau périodique sont appelés gaz rares. Ces éléments sont très stables chimiquement. Pour raccourcir le processus de l'écriture d'un long configuration électronique, il suffit d'écrire le symbole chimique de la plus proche chimique de gaz avec moins d'électrons que votre atome entre parenthèses, puis continuer avec la configuration électronique pour la suite de l'orbitale ensembles. Voir ci-dessous:
- Pour comprendre ce concept, il est utile d'écrire un exemple de configuration. Nous allons écrire une configuration pour le Zinc (numéro atomique 30) à l'aide de gaz noble de sténographie. Le Zinc complet de la configuration électronique est: 1s2 2s2 2p6 3s2 3p6 4s2 3d10. Toutefois, notez que 1s2 2s2 2p6 3s2 3p6 est la configuration pour l'Argon, un gaz noble. Il suffit de remplacer cette partie de Zinc de l'électron de notation avec de l'Argon du symbole chimique entre crochets ([Ar].)
- Donc, le Zinc configuration électronique écrit en abréviation est [Ar]4s2 3d10.
@@_
@@
Méthode 2
à l'Aide d'un ADOMAH Tableau Périodique

1
@@_
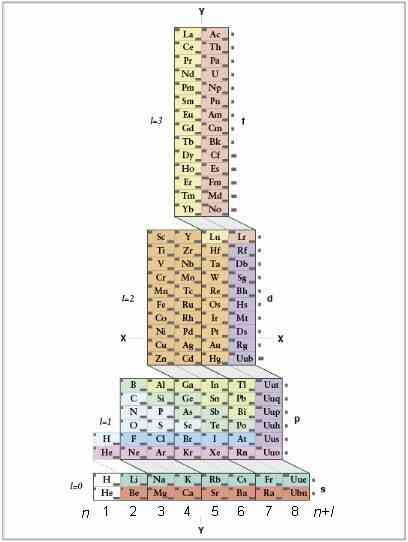
@@Comprendre les ADOMAH Tableau Périodique. Cette méthode d'écriture des électrons configurations ne nécessite pas de mémorisation. Cependant, il nécessite un réarrangés tableau périodique, parce que dans le traditionnel tableau périodique, début de la quatrième ligne, la période de numéros ne correspondent pas aux électrons. Trouver un ADOMAH Tableau Périodique, un type spécial de périodique tableau conçu par les scientifiques Valery Tsimmerman. Il est facilement trouvable via une rapide recherche en ligne.[2]
- Dans la ADOMAH Tableau Périodique, les lignes horizontales représentent des groupes d'éléments, tels que les halogènes, gaz inertes, métaux alcalins, alcalino-terreux, etc. Colonnes verticales correspondent aux électrons et de soi-disant “cascades” (lignes diagonales reliant s,p,d et f blocs) correspondent à des périodes.
- l'Hélium est déplacé à côté de l'Hydrogène, puisque les deux d'entre eux sont caractérisés par l'orbitale 1s. Les blocs de périodes (s,p,d et f) sont affichés sur le côté droit et shell sont indiquées à la base. Les éléments sont présentés dans des boîtes rectangulaires qui sont numérotés de 1 à 120. Ces chiffres sont normaux numéros atomiques qui représentent le nombre total d'électrons dans un atome neutre.
2
@@_
@@Trouver votre atome dans la ADOMAH table. Pour écrire configuration électronique d'un élément, de localiser son symbole dans ADOMAH Tableau Périodique et de la croix de tous les éléments qui ont plus de numéros atomiques. Par exemple, si vous avez besoin d'écrire configuration électronique de l'Erbium (68), une croix sur les éléments de 69 à 120.
- Avis de numéros de 1 à 8 à la base de la table. Ces électrons shell nombres, ou les numéros de colonne. Ignorer les colonnes qui contiennent seulement traversé les éléments. Pour l'Erbium colonnes restantes sont 1,2,3,4,5 et 6.
3
@@_
@@Comte orbital ensembles jusqu'à votre atome. En regardant le bloc de symboles qui s'affichent sur le côté droit de la table (s, p, d et f) et à la colonne des numéros indiqués à la base, et en ignorant les lignes diagonales entre les blocs, de rupture de colonnes dans la colonne de blocs et de les énumérer dans l'ordre, de bas en haut. De nouveau, ignorer la colonne de blocs où tous les éléments se sont croisés. Écrire en bas de la colonne de blocs commençant par le numéro de la colonne, suivi par le bloc de symbole, comme ceci: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (dans le cas de l'Erbium).
- Note: La configuration électronique de l'Er est écrit dans l'ordre croissant de shell numéros. Il pourrait également être écrits dans l'ordre de l'orbite de remplissage. Il suffit de suivre les cascades de haut en bas au lieu de colonnes lorsque vous écrivez en bas de la colonne de blocs: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12.
4
@@_
@@Comte d'électrons pour chaque orbitale ensemble. Compte des éléments qui n'ont pas été franchi dans chaque bloc-colonne, l'attribution d'un électron par élément, et d'écrire leur quantité à côté du bloc de symboles de chaque bloc-colonne, comme ceci: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f12 5s2 5p6 6s2. Dans notre exemple, c'est la configuration électronique de l'Erbium.
5
@@_
@@Sais irrégulière électron configurations. Il y a dix-huit exceptions communes de l'électron configurations pour des atomes dans l'état de plus basse énergie, aussi appelé le sol de l'état. Ils s'écarter de la règle générale que par dernier de deux à trois électrons positions. Dans ces cas, la configuration électronique maintient les électrons dans un état d'énergie moindre que dans une configuration standard de l'atome. L'irrégularité des atomes sont:
- Cr (..., 3d5, 4s1) Cu (..., 3d10, 4s1) Nb (..., 4d4, 5s1) Mo (..., 4d5, 5s1) Ru (..., 4d7, 5s1) Rh (..., 4d8, 5s1) Pd (..., 4d10, 5s0) Ag (..., 4d10, 5s1) La (..., 5do1, 6s2) Ce (..., 4f1, 5do1, 6s2) Gd (..., 4f7, 5do1, 6s2) Au (..., 5d10, 6s1) Ac (..., 6d1, 7s2) Th (..., 6d2, 7s2) Pa (..., 5f2, 6d1, 7s2) U (..., 5f3, 6d1, 7s2) Np (..., 5f4, 6d1, 7s2) et Cm (..., 5f7, 6d1, 7s2).
Comment Ecrire des Electrons Configurations pour des Atomes d'un Element
Un atome de configuration electronique est une representation numerique de son electron orbitales. Aux orbites electroniques sont de formes differentes regions autour d'un noyau d'atome ou les electrons sont mathematiquement susceptibles d'etre situe. Un electron de configuration peuvent rapidement et simplement dire a un lecteur de combien d'electrons orbitales d'un atome est ainsi que le nombre d'electrons de remplissage de chacun de ses orbitales. Une fois que vous comprenez les principes de base derriere configuration electronique, vous serez en mesure d'ecrire vos propres configurations et de s'attaquer a ceux de la chimie des tests avec confiance.
Mesures
@@_
@@
Methode 1
Attribution d'Electrons a l'Aide d'un Tableau Periodique


1
@@_
@@Trouver votre atome de numero atomique. Chaque atome a un nombre precis d'electrons associes. Recherchez votre atome de symbole chimique du tableau periodique. Le numero atomique est un nombre entier positif a partir de 1 (pour l'hydrogene) et augmente de 1 pour chaque atome. L'atome de numero atomique est le nombre de protons de l'atome - ainsi, c'est aussi le nombre d'electrons dans un atome avec zero frais.2
@@_
@@de Determiner la charge de l'atome. Sans inculpation atomes aura exactement le nombre d'electrons qui est representee sur le tableau periodique. Cependant, les atomes charges aura une augmentation ou une diminution du nombre d'electrons en fonction de l'importance de leur charge. Si vous travaillez avec un atome charge, d'ajouter ou de soustraire des electrons en consequence: ajouter un electron pour chaque charge negative et soustraire un pour chaque charge positive.
- Par exemple, un atome de sodium avec un 1 charge aurait un electron de s'eloigner de ses base du numero atomique de 11. Ainsi, l'atome de sodium aurait 10 electrons au total.
3
@@_
@@Memoriser la liste de base des orbitales. Comme un atome gains electrons, ils remplissent differentes orbitales ensembles selon un ordre specifique. Chaque ensemble d'orbitales, lorsqu'il est complet, contient un nombre pair d'electrons. Les orbitales ensembles sont:
- La s orbital jeu (n'importe quel nombre dans la configuration electronique suivi d'un 's') contient une seule orbitale, et par le Principe d'Exclusion de Pauli, une seule orbitale peut contenir un maximum de 2 electrons, de sorte que chaque s orbitale peut contenir 2 electrons.
- L'orbitale p set contient 3 orbitales, et donc peut contenir un total de 6 electrons.
- Le d orbital set contient 5 orbitales, de sorte qu'il peut contenir 10 electrons.
- La f orbital set contient 7 orbitales, de sorte qu'il peut contenir 14 electrons.
Rappelez-vous l'ordre des lettres avec ce mnemonique:[1]Sobre, les Physiciens Ne Trouvez pas les Girafes se Cachant Dans les Cuisines.Pour des atomes avec encore plus d'electrons, les orbitales continuer par ordre alphabetique passe K, de sauter des lettres deja utilise.
4
@@_
@@Comprendre la configuration electronique de la notation. Electron configurations sont rediges de maniere a afficher clairement le nombre d'electrons dans l'atome ainsi que le nombre d'electrons dans chaque orbitale. Chaque orbitale est ecrit dans l'ordre, avec le nombre d'electrons dans chaque orbitale ecrit en exposant a droite de l'orbitale nom. La finale de la configuration electronique est une chaîne unique de l'orbite des noms et des exposants.
- Par exemple, voici une simple configuration electronique: 1s2 2s2 2p6. Cette configuration montre qu'il y a deux electrons dans l'orbitale 1s ensemble, deux electrons dans l'orbitale 2s ensemble, et six electrons dans l'orbitale 2p ensemble. 2 2 6 = 10 electrons total. Cette configuration electronique est un non charge neon atome (neons de numero atomique est de 10.)
5
@@_
@@Memoriser l'ordre des orbitales. Notez que les orbitales series sont numerotees par des electrons shell, mais commande en termes d'energie. Par exemple, une fois rempli, un 4s2 est plus faible energie (ou du moins potentiellement volatils) que partiellement remplis ou rempli 3d10, de sorte que le 4s coque est indique en premier. Une fois que vous savez l'ordre du reservoir, il vous suffit de remplir leur fonction du nombre d'electrons dans l'atome. L'ordre de remplissage des orbitales est comme suit: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7p, 5f, 6d, 7p, 8s.
- Une configuration electronique d'un atome a chaque orbitale completement rempli serait ecrit: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d107p6
- Notez que la liste ci-dessus, si toutes les coquilles ont ete remplis, ce serait la configuration electronique pour Uuo (Ununoctium), 118, le plus grand numero de l'atome dans le tableau periodique - donc cette configuration electronique contient tous connus a l'heure actuelle de la couche electronique pour une charge neutre atome.
6
@@_
@@Remplir le reservoir en fonction du nombre d'electrons dans votre atome. Par exemple, si nous voulons ecrire un electron de configuration pour un non charge atome de calcium, nous allons commencer par trouver son numero atomique sur le tableau periodique. Son numero atomique est de 20, de sorte que nous allons ecrire une configuration pour un atome a 20 electrons selon l'ordre ci-dessus.
- Remplir reservoir selon l'ordre ci-dessus jusqu'a ce que vous atteindre vingt total d'electrons. L'orbitale 1s obtient deux electrons, le 2s obtient deux, la 2p obtient six, le 3s obtient deux, le 3p obtient 6, et le 4s obtient 2 (2 2 6 2 6 2 = 20.) Ainsi, la configuration electronique de calcium est: 1s2 2s2 2p6 3s2 3p6 4s2.
- Note: le niveau d'Energie des modifications que vous allez vers le haut. Par exemple, lorsque vous etes sur le point d'aller jusqu'a la 4eme niveau d'energie, il devient 4s d'abord, puis en 3d. Apres le quatrieme niveau d'energie, vous vous deplacez sur le 5e, ou il suit l'ordre une fois de plus. Cela se produit uniquement apres la 3eme niveau d'energie.
7
@@_
@@Utiliser le tableau periodique comme un raccourci visuel. Vous avez peut-etre deja remarque que la forme de la table periodique correspond a l'ordre de l'orbite de jeux dans des electrons configurations. Par exemple, les atomes dans la deuxieme colonne en partant de la gauche, de toujours se terminer par 's2', des atomes a l'extreme droite de la maigre partie mediane toujours la terminaison 'd10', etc. Utiliser le tableau periodique comme un guide visuel pour ecrire des configurations de l'ordre dans lequel vous ajoutez les electrons des orbitales correspond a votre position dans le tableau. Voir ci-dessous:
- plus Precisement, les deux colonnes de gauche representent des atomes dont les electrons configurations de fin dans les orbitales s, le bloc de droite de la table represente les atomes dont les configurations fin dans les orbitales p, la partie mediane, les atomes de cette fin d orbital, et la partie inferieure, les atomes qui se terminent en f orbitales.
- Par exemple, lors de l'ecriture d'une configuration electronique du Chlore, pense que: 'Cet atome est dans la troisieme rangee (ou 'periode') du tableau periodique. C'est aussi dans la cinquieme colonne du tableau periodique de l'orbitale p du bloc. Ainsi, sa configuration electronique ...3p5
- Attention - le d et f orbital regions du tableau correspondent a des niveaux d'energie qui sont differentes de celles de la periode ou ils sont situes. Par exemple, la premiere ligne de la d orbital bloc correspond a la 3d orbital meme si c'est en periode 4, tandis que la premiere ligne de la f orbitale correspond a l'orbitale 4f meme si c'est en periode de 6.
8
@@_
@@Apprendre la stenographie pour la redaction long de l'electron configurations. Les atomes le long du bord droit du tableau periodique sont appeles gaz rares. Ces elements sont tres stables chimiquement. Pour raccourcir le processus de l'ecriture d'un long configuration electronique, il suffit d'ecrire le symbole chimique de la plus proche chimique de gaz avec moins d'electrons que votre atome entre parentheses, puis continuer avec la configuration electronique pour la suite de l'orbitale ensembles. Voir ci-dessous:
- Pour comprendre ce concept, il est utile d'ecrire un exemple de configuration. Nous allons ecrire une configuration pour le Zinc (numero atomique 30) a l'aide de gaz noble de stenographie. Le Zinc complet de la configuration electronique est: 1s2 2s2 2p6 3s2 3p6 4s2 3d10. Toutefois, notez que 1s2 2s2 2p6 3s2 3p6 est la configuration pour l'Argon, un gaz noble. Il suffit de remplacer cette partie de Zinc de l'electron de notation avec de l'Argon du symbole chimique entre crochets ([Ar].)
- Donc, le Zinc configuration electronique ecrit en abreviation est [Ar]4s2 3d10.
@@_
@@
Methode 2
a l'Aide d'un ADOMAH Tableau Periodique


1
@@_
@@Comprendre les ADOMAH Tableau Periodique. Cette methode d'ecriture des electrons configurations ne necessite pas de memorisation. Cependant, il necessite un rearranges tableau periodique, parce que dans le traditionnel tableau periodique, debut de la quatrieme ligne, la periode de numeros ne correspondent pas aux electrons. Trouver un ADOMAH Tableau Periodique, un type special de periodique tableau conçu par les scientifiques Valery Tsimmerman. Il est facilement trouvable via une rapide recherche en ligne.[2]
- Dans la ADOMAH Tableau Periodique, les lignes horizontales representent des groupes d'elements, tels que les halogenes, gaz inertes, metaux alcalins, alcalino-terreux, etc. Colonnes verticales correspondent aux electrons et de soi-disant “cascades” (lignes diagonales reliant s,p,d et f blocs) correspondent a des periodes.
- l'Helium est deplace a cote de l'Hydrogene, puisque les deux d'entre eux sont caracterises par l'orbitale 1s. Les blocs de periodes (s,p,d et f) sont affiches sur le cote droit et shell sont indiquees a la base. Les elements sont presentes dans des boîtes rectangulaires qui sont numerotes de 1 a 120. Ces chiffres sont normaux numeros atomiques qui representent le nombre total d'electrons dans un atome neutre.
2
@@_
@@Trouver votre atome dans la ADOMAH table. Pour ecrire configuration electronique d'un element, de localiser son symbole dans ADOMAH Tableau Periodique et de la croix de tous les elements qui ont plus de numeros atomiques. Par exemple, si vous avez besoin d'ecrire configuration electronique de l'Erbium (68), une croix sur les elements de 69 a 120.
- Avis de numeros de 1 a 8 a la base de la table. Ces electrons shell nombres, ou les numeros de colonne. Ignorer les colonnes qui contiennent seulement traverse les elements. Pour l'Erbium colonnes restantes sont 1,2,3,4,5 et 6.
3
@@_
@@Comte orbital ensembles jusqu'a votre atome. En regardant le bloc de symboles qui s'affichent sur le cote droit de la table (s, p, d et f) et a la colonne des numeros indiques a la base, et en ignorant les lignes diagonales entre les blocs, de rupture de colonnes dans la colonne de blocs et de les enumerer dans l'ordre, de bas en haut. De nouveau, ignorer la colonne de blocs ou tous les elements se sont croises. Ecrire en bas de la colonne de blocs commençant par le numero de la colonne, suivi par le bloc de symbole, comme ceci: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (dans le cas de l'Erbium).
- Note: La configuration electronique de l'Er est ecrit dans l'ordre croissant de shell numeros. Il pourrait egalement etre ecrits dans l'ordre de l'orbite de remplissage. Il suffit de suivre les cascades de haut en bas au lieu de colonnes lorsque vous ecrivez en bas de la colonne de blocs: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12.
4
@@_
@@Comte d'electrons pour chaque orbitale ensemble. Compte des elements qui n'ont pas ete franchi dans chaque bloc-colonne, l'attribution d'un electron par element, et d'ecrire leur quantite a cote du bloc de symboles de chaque bloc-colonne, comme ceci: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f12 5s2 5p6 6s2. Dans notre exemple, c'est la configuration electronique de l'Erbium.
5
@@_
@@Sais irreguliere electron configurations. Il y a dix-huit exceptions communes de l'electron configurations pour des atomes dans l'etat de plus basse energie, aussi appele le sol de l'etat. Ils s'ecarter de la regle generale que par dernier de deux a trois electrons positions. Dans ces cas, la configuration electronique maintient les electrons dans un etat d'energie moindre que dans une configuration standard de l'atome. L'irregularite des atomes sont:
- Cr (..., 3d5, 4s1) Cu (..., 3d10, 4s1) Nb (..., 4d4, 5s1) Mo (..., 4d5, 5s1) Ru (..., 4d7, 5s1) Rh (..., 4d8, 5s1) Pd (..., 4d10, 5s0) Ag (..., 4d10, 5s1) La (..., 5do1, 6s2) Ce (..., 4f1, 5do1, 6s2) Gd (..., 4f7, 5do1, 6s2) Au (..., 5d10, 6s1) Ac (..., 6d1, 7s2) Th (..., 6d2, 7s2) Pa (..., 5f2, 6d1, 7s2) U (..., 5f3, 6d1, 7s2) Np (..., 5f4, 6d1, 7s2) et Cm (..., 5f7, 6d1, 7s2).
Comment Écrire des Électrons Configurations pour des Atomes d'un Élément
By commentfaire
Un atome de configuration électronique est une représentation numérique de son électron orbitales. Aux orbites électroniques sont de formes différentes régions autour d'un noyau d'atome où les électrons sont mathématiquement susceptibles d'être situé. Un électron de configuration peuvent rapidement et simplement dire à un lecteur de combien d'électrons orbitales d'un atome est ainsi que le nombre d'électrons de remplissage de chacun de ses orbitales. Une fois que vous comprenez les principes de base derrière configuration électronique, vous serez en mesure d'écrire vos propres configurations et de s'attaquer à ceux de la chimie des tests avec confiance.